Unser Forschungsschwerpunkt
Unsere Forschungsprojekte sind in drei Transition Topics – „Resilience, Recovery und Borders“ – organisiert. Diese vereinen zentrale Pathomechanismen zu übergeordneten Krankheitskonzepten und erscheinen besonders geeignet für die klinische Translation. Die Transition Topics erfordern größere, multidisziplinäre Forschungsteams unter Einbeziehung der Expertise von Clinician-Scientists.
Die Forschung innerhalb dieser Transition Topics sind als Tandemprojekte strukturiert.
Ergänzt wird das Forschungsprogramm durch Technology Hubs, die eine zentrale methodische Unterstützung bereitstellen.
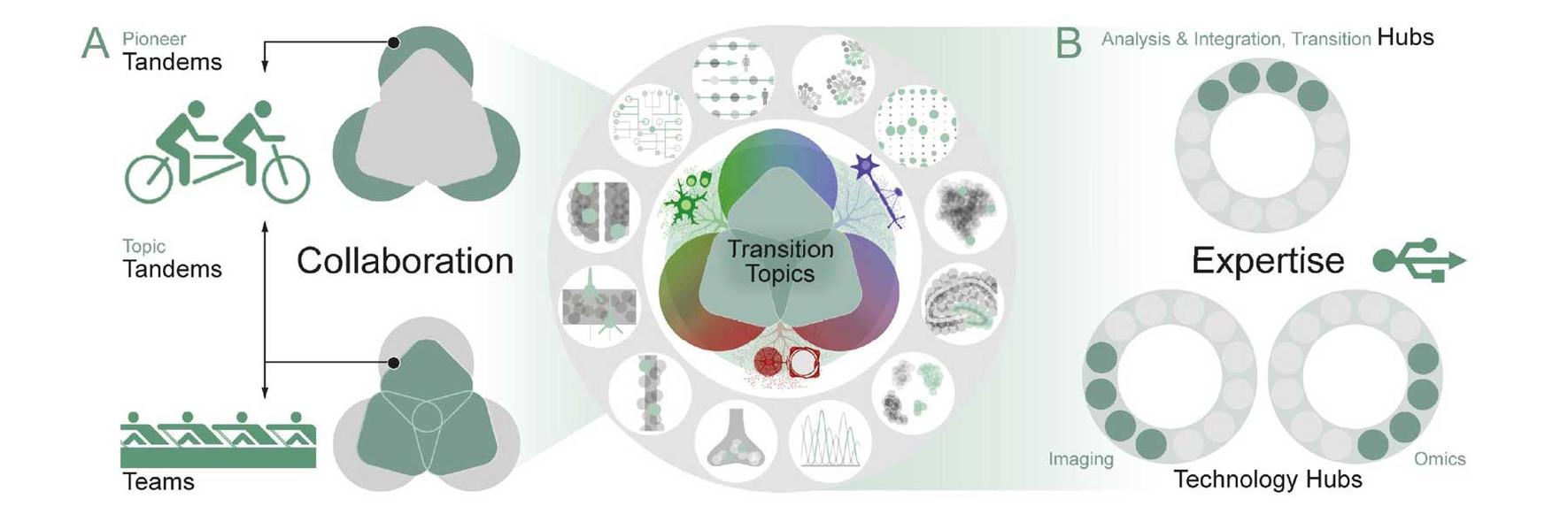
Struktur des SyNergy-Forschungsprogramms: A. Tandems sind das prägende Kernelement des Clusters und werden „bottom-up“ von zwei SyNergy Wissenschaftlern mit komplementärer Expertise initiiert (PIs, SyNergy-Professorinnen und -Professoren oder Mitglieder der Early Excellence Academy). Tandems erschließen entweder neue wissenschaftliche oder technologische Felder (Pioneer Tandems) oder entwickeln neue Aspekte der Transition Topics (Topic Tandems) – mit der Option, neue Teams zu initiieren oder bestehende zu erweitern. Die neuen Teams bestehen aus vier bis sechs Forschenden aus unterschiedlichen Disziplinen, einschließlich klinischer Expertinnen und Experten, und arbeiten innerhalb eines der derzeit drei Transition Topics (dunkelgrüne Quadrate), um die klinische Translation zu stärken. B. Teams und Tandems werden durch Hubs unterstützt und sind an zentrale Infrastrukturen wie die Research-Data-Management-Plattform des Clusters sowie an dessen translationale Partner angebunden.
Unsere drei Transition Topics
Edbauer / Höglinger / Brendel / Haass / Korn / Zhou
Zelluläre Resilienz und Schutzmechanismen sind essenziell für Neuronen. Als postmitotische Zellen besitzen Neuronen nur eine begrenzte Regenerationsfähigkeit und akkumulieren aufgrund ihrer langen Lebensdauer altersassoziierte Schäden an DNA, Lipiden und Proteinen. Dennoch tritt neuronaler Verlust bei den meisten chronischen ZNS-Erkrankungen vergleichsweise langsam und erst spät auf. Diese Verzögerung ist auf robuste, dem Nervensystem inhärente Resilienz- und Schutzsysteme zurückzuführen.
Die intrinsische neuronale Resilienz umfasst beispielsweise das Proteostase-Netzwerk mit einer umfangreichen Maschinerie aus molekularen Chaperonen, Enzymen und Proteasen. Neuronen können ihre Funktion jedoch nicht ohne unterstützende Zellen wie Astrozyten oder Oligodendrozyten aufrechterhalten, die neuronalen Stress erkennen und als Reaktion zusätzliche extrinsische Schutzebenen bereitstellen (siehe Team „Circuit Recovery and Repair“).
Sobald diese Systeme an ihre Grenzen stoßen, werden alternative Abwehrmechanismen aktiviert, die zu einer abgestuften Gewebeentzündung führen, typischerweise beginnend mit der Mikroglia. Während solche Reaktionen protektiv sein und die Homöostase wiederherstellen können, kann bei anhaltender schädlicher Stimulation eine Rekrutierung peripherer Immunzellen erfolgen. Unter chronischen Bedingungen können sich selbstverstärkende Entzündungszyklen entwickeln, die zu Gewebedestruktion führen.
Innerhalb von SyNergy haben wir die Perspektive von einer neuronenzentrierten Sichtweise hin zu einem multizellulären homöostatischen Netzwerk aus Immunzellen, Glia und Gefäßsystem erweitert.
Zukünftig ist es unser zentrales Ziel, die molekularen und zellulären Grundlagen der verschiedenen Ebenen von Resilienz und Schutz bei degenerativen, inflammatorischen und vaskulären ZNS-Erkrankungen zu verstehen. Unser Hauptanliegen ist es zu klären, wie diese Systeme zusammenwirken, um Pathologien entgegenzuwirken, und wie fehlangepasste Antworten pathologische Prozesse verstärken können. Wir sind überzeugt, dass ein hochauflösendes Verständnis der endogenen Mechanismen zellulärer Resilienz und Schutzfunktionen der Schlüssel zur Entwicklung therapeutischer Strategien ist, die diese Mechanismen gezielt nutzen.

Tandem Projects – „Cell Resilience & Protection“
- CNS protection by control of disease-associated glial states
Ninkovic, Simons - Epigenetic regulation of microglial responses to aging and inflammation
Neher, Schäfer - Inflammatory axon degeneration as a consequence of metabolic vulnerability
Kerschensteiner, Misgeld
„Circuit Recovery & Repair“ wird als Reaktion auf neuronale Schädigung in verschiedensten ZNS-Erkrankungen ausgelöst. Diese Antwort beruht auf dem koordinierten Zusammenspiel von Neuronen, Gliazellen und Immunzellen. Unter den glialen Reparaturmechanismen nimmt die Remyelinisierung, die für eine effektive Schaltkreisfunktion erforderlich ist, insbesondere bei neuroinflammatorischen Erkrankungen mit ausgeprägtem Myelinverlust eine zentrale Rolle ein. Myelinreparatur stellt jedoch auch nach akuten ZNS-Verletzungen ein relevantes therapeutisches Ziel dar.
Zu den neuronalen Reparaturmechanismen zählt die Umgestaltung geschädigter neuronaler Schaltkreise, selbst ohne langstreckige axonale Regeneration, die für die endogene funktionelle Erholung essenziell, jedoch häufig unzureichend ist. In neurodegenerativen Erkrankungen sind diese Reparaturmechanismen aufgrund des massiven neuronalen Verlusts besonders eingeschränkt. Dennoch können frühe Biomarker – wie sie von SyNergy-Forschenden und anderen etabliert wurden – das Zeitfenster erweitern, um Neuronen vor dem Zelltod zu retten und eine Reorganisation und Anpassung neuronaler Netzwerke zu fördern.
Zur therapeutischen Nutzung der Schaltkreis-Umgestaltung über verschiedene neurologische Erkrankungen hinweg haben sich zwei zentrale Interventionspunkte herauskristallisiert:
Erstens die gezielte Beeinflussung von Mechanismen, die die Umgestaltung erhaltener neuronaler Schaltkreise begrenzen. Hier konnten wir sowohl neuron-intrinsische als auch extrinsische – d. h. gliale und immunologische – Regulatoren identifizieren, die neuronale Reaktionen am Läsionsort und darüber hinaus steuern.
Zweitens - bei zu starkem neuronalen Verlust - der einen funktionellen Wiederaufbau allein durch Plastizität unmöglich macht, die Wiederherstellung von Neuronen. Wir konnten zeigen, dass neu gebildete Neuronen sich strukturell und funktionell in bestehende, geschädigte Schaltkreise integrieren können.
Zukünftig ist es das zentrale Ziel von SyNergy, diese Interventionsstrategien in Richtung einer therapeutischen Unterstützung der Schaltkreis-Erholung und -Reparatur zu überführen. Ein entscheidender Schritt besteht darin, zu verstehen, wie therapeutische Konzepte an unterschiedliche Gewebeumgebungen und Krankheitsverläufe bei degenerativen, vaskulären oder inflammatorischen ZNS-Schädigungen angepasst werden müssen. Ein weiterer wichtiger Schritt ist die Einbindung humaner Modellsysteme, um artübergreifend konservierte regulatorische Prinzipien und Modulationsstrategien zu identifizieren.

Tandem Projects – Circuit Recovery & Repair
- Tailored approaches to improve circuit rewiring across CNS pathologies
Bareyre, Wahl - Role of tubular ER extensions in oligodendrocytes during remyelination
Harbauer, Simons - Analysis of remyelination factors across species and injury conditions
Hemmer, Misgeld
Bareyre / Ertürk / Paquet / Neher / Dichgans
Hirn-Grenzstrukturen und -Schnittstellen wie die Blut-Hirn-Schranke sowie die Hüllen des ZNS – einschließlich Meningen, Ependym und Plexus choroideus – aber auch das Knochenmark der Kalotte und anderer Knochen erweisen sich als wichtige Akteure bei neurologischen Erkrankungen. Ein Ausfall der Blut-Hirn-Schranke, häufig in Kombination mit einer Aktivierung der angeborenen Immunantwort, trägt wesentlich zu Neuroinflammation, Schlaganfall und Neurodegeneration einschließlich der Alzheimer-Erkrankung bei.
Einige Mechanismen, etwa fibrinvermittelte Entzündung und oxidativer Stress, überschneiden sich zwischen Neuroinflammation und Neurodegeneration und eröffnen Möglichkeiten für krankheitsübergreifende Interventionen. Gleichzeitig unterscheiden sich die funktionellen sowie zeitlich-räumlichen Charakteristika humoraler Veränderungen (z. B. Durchlässigkeit und Immunmediatoren) und zellulärer Reaktionen (z. B. Immunzellinvasion und Fibrose) an den Hirn-Schnittstellen je nach Erkrankung.
Neue Technologien ermöglichen es heute, den Beitrag von ZNS-Grenzstrukturen mit bislang unerreichter Auflösung zu untersuchen. Dazu zählen unter anderem Single-Cell- und Spatial-Transcriptomics, optisches Tissue Clearing, neuartige PET-Tracer, humane iPSC-basierte 3D-Modelle der neurovaskulären Einheit sowie kompartiment-spezifische Proteomik. In der letzten Förderperiode haben SyNergy-Forschende die Anwendung dieser Methoden maßgeblich vorangetrieben und gezeigt, wie unterschiedliche ZNS-Grenzkompartimente auf neurodegenerative, neuroinflammatorische und neurovaskuläre Schädigungen reagieren. Dabei wurden krankheitsübergreifende Reaktionsmuster identifiziert, darunter die Reorganisation der extrazellulären Matrix (ECM) als aktiver Beitrag zur ZNS-Pathologie.
Zukünftig ist es unser zentrales Ziel, die gemeinsamen regulatorischen Prinzipien zu verstehen, die die Rolle von ZNS-Grenzstrukturen bei Erkrankungen des Nervensystems bestimmen. Wir sind überzeugt, dass die Aufklärung der zeitlichen, räumlichen und krankheitsspezifischen Faktoren, welche die zelluläre und molekulare Kommunikation an ZNS-Grenzstrukturen und deren Interaktion mit peripheren Kompartimenten beeinflussen, unser Verständnis der Entstehung und Aufrechterhaltung von ZNS-Pathologien entscheidend vertiefen wird. Dies ist von zentraler Bedeutung für die Entwicklung therapeutischer Strategien, die entweder direkt auf ZNS-Grenzfunktionen abzielen oder diese Schnittstellen für einen optimierten Zugang zum ZNS nutzen.

Tandem Projects Research Area C
- Comparative analysis of marrow-derived immune cells across brain diseases
Ertürk, Liesz - Astrocyte mitochondrial regulation in metabolic control
García Cáceres, Perocchi - Myeloid cell entry and polarization in the inflamed and ischemic CNS
Dichgans, Kerschensteiner
„Pioneer“-Tandems
Wir werden das äußerst erfolgreiche Format der „Pioneer“-Tandems fortführen. Neben der thematischen und technologischen Erweiterung des Clusters ermöglichen diese Tandems neue Kooperationen, die Integration neuer Forschender (z. B. aus der Early Excellence Academy oder aus Neuberufungen) sowie die Erschließung neuer Themen mit krankheitsübergreifendem Potenzial.
Unsere Technology Hubs für methodische Unterstützung
Die Technology Hubs bieten den SyNergy-Mitgliedern Zugang zu zwei Bereichen der "Omics"- und bildgebenden Technologien auf verschiedenen Analyseebenen und -skalen, von Systemen bis hin zu Kliniken.
Die Hubs sind als institutionsübergreifende Einheiten organisiert - alle Hubs werden von drei SyNergy-Experten aus mindestens zwei verschiedenen Institutionen koordiniert.
Open Science
SyNergy hat sich verpflichtet, Forschungstransparenz und Reproduzierbarkeit sowohl in quantitativen als auch in qualitativen Forschungsprojekten zu fördern. Wir betrachten die Fähigkeit, quantitative oder qualitative Forschungsergebnisse zu replizieren und zu reproduzieren, als fundamentale Säulen, die die Verallgemeinerbarkeit und Zuverlässigkeit wissenschaftlicher Erkenntnisse unterstützen.
SyNergy ist Mitglied im Open Science Center.
Transition Topics
Diese neue Maßnahme basiert auf unserer Überzeugung, dass die Umsetzung eines potenziellen translationalen Zieles größere und multidisziplinäre Forschungsteams erfordert, einschließlich der Expertise von Clinician Scientists. Transition Topics sind komplexer und strukturell stärker skalierbar als Tandems, um den Anforderungen spezifischer wissenschaftlicher Fragestellungen gerecht zu werden. Vier bis sechs SyNergy Wissenschaftler untersuchen gemeinsam das medizinische Potenzial krankheitsübergreifender Pathomechanismen oder treiben ein Ziel entlang der einzelnen Transitionsschritte bis hin zur klinischen Anwendung voran, indem sie mehrere Arbeitsmodule (Multi-Aim Workpackages) verfolgen.
Tandemprojekte sind hochgradig kollaborative Forschungsprojekte. Sie kombinieren Expertise über klassische Pathomechanismen hinweg sowie Werkzeuge der Systembiologie und Systemneurowissenschaften. Darüber hinaus werden in vielen Projekten die Forschungsaktivitäten von Wissenschaftlerinnen und Wissenschaftlern sowie Klinikerinnen und Klinikern gebündelt. Dadurch lassen sich Ansätze von in-vitro-Modellen bis hin zu klinischen Studien miteinander verbinden.
„Pioneer“-Tandems: Neben der thematischen und technologischen Erweiterung des Clusters ermöglichen diese Tandems neue Kooperationen, erlauben die Integration neuer Forschender (z. B. aus der Early Excellence Academy oder aus Neuberufungen) oder erkunden neue Themen mit krankheitsübergreifendem Potenzial, da das Projektportfolio des Clusters sehr dynamisch ist.